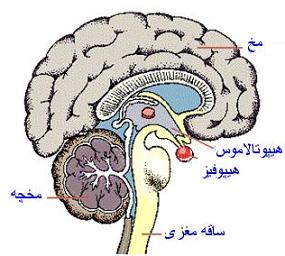
هیپوفیز، غدهای است به اندازه فندق و در حفره زین ترکی که حفرهای استخوانی در قاعده مغز در قدام دیافراگم زین قرار دارد. وزن غده هیپوفیز حدود 600 میلیگرم میباشد.
از نظر آناتومی و عملکردی، این غده دو لوب مشخص قدامی و خلفی دارد. زین با ساختمانهای عصبی و عروقی شامل سینوسهای کاورنو، اعصاب جمجمهای و کیاسمای بینایی مجاورت دارد. سلولهای عصبی هیپوتالاموس، هورمونهای ویژه آزادکننده و مهارکنندهای میسازند که بهطور مستقیم به داخل عروق پورت ساقه هیپوفیز ترشح میشوند. خونرسانی غده هیپوفیز از شریانهای فوقانی و تحتانی هیپوفیزی تأمین میشود. اپیتلیوم سقف حلق جنین به سمت بالا کشیده شده و ارتباط خود را با دهان قطع میکند و با بخشی از دیانسفال یا مغز واسطهای، در غلاف واحدی قرار گرفته و غده هیپوفیز را میسازند. به همین دلیل هیپوفیز دارای دو بخش است:
· بخش قدامی که بزرگتر بوده و ساختمان غدهای دارد که آدنو هیپوفیز نامیده میشود.
· بخش خلفی که به هیپوتالاموس مربوط است و نورو هیپوفیزنامیده میشود.
بین این دو قسمت، بخش کوچک و نسبتا بیعروقی به نام بخش میانی قرار دارد که در انسان تقریبا وجود ندارد ولی در حیوانات پست، بزرگتر و فعالتر میباشد. منشأ جنینی این دو قسمت غده هیپوفیز، متفاوت است. هیپوفیز قدامی از کیسه راتکه، که یک تورفتگی جنینی اپیتلیوم حلقی، نشاندهنده ماهیت اپیتلیوئیدی این سلولها است و خاستگاه هیپوفیز خلفی از بافت عصبی نشاندهنده وجود تعداد زیادی سلولهای گلیال در این غده است.هیپوفیز توسط ساقهای به کف بطن سوم متصل است. سیستم وریدی هیپوفیز، سیستم باب است. باب به نوعی گردش خون وریدی گفته میشود که دو بار از مویرگها عبور میکند و به نظر میرسد که خون وریدی هیپوفیز قبل از ورود به جریان عمومی خون از هیپوتالاموس عبور میکند و همین امر، ارتباط نزدیک هیپوفیز با دستگاه خودمختار بهویژه سمپاتیک را نشان میدهد.
ساختمان بافت هیپوفیز پیشین(آدنو هیپوفیز)
هیپوفیز پیشین، دارای سه نوع سلول ترشحی به نامهای اسیدوفیل، بازوفیل و کروموفوب میباشد. گروه اول با رنگهای اسیدی مانند ائوزین رنگ میگیرند. گروه دوم رنگهای قلیایی را به خود جذب میکنند و کروموفوبها هیچکدام از این دو نوع رنگ را به خود نمیگیرند. سلولهای اسیدوفیل، هورمونهای رشد و پرولاکتین را میسازند. سلولهای بازوفیل، سازنده هورمونهای محرک فولیکولی(FSH)، لوتئینی(LH)، تیروئید و بخش قشر غدد فوقکلیوی هستند.
غده هیپوفیز و هیپوتالاموس{نحوه کنترل ترشح هورمون}
هورمون های هیپوفیز به صورت ضربانی ترشح می شوند.که نمایانگر تحریک متناوب هیپوفیز با فاکتورهای آزاد کننده هیپوتالاموس است.هر یک از این هورمون های هیپوفیزی پاسخ های خاصی را در غدد محیطی هدف باعث می شوند . در مقابل هورمون های غدد محیطی به طور پسخوراند کنترلی را در سطح هیپوتالاموس و هیپوفیز اعمال میکنند تا عملکرد هیپوفیز تعدیل گردد.
معرفی pomc
POMC یک پروتئین پیش ساز شامل 285 اسیدآمینه است که توسط یک ژن واحد ساخته می شود.پس از ساخت این پروهورمون تحت تاثیر آنزیم ها شکسته شده و تغییرات مناسب بر اثر گلیکوزیلاسیون،استیلاسیون و فسفریلاسیون در آن حاصل می شود و هورمون های ACTH ،β-LPH و α-MSH ایجاد می گردند.
محصول نهایی تشکیل شده از proopiomelanocortinدر هیپوفیز میانی عمدتا MSHα و مقداری MSHβ است. به این صورت که از شکستن proopiomelanocortinدو محصول عمده به نام های adernocorticotrophin hormone (ACTH) و β-lipotrophin hormone حاصل می شود. و از این دو محصول در هیپوفیز میانی MSHα و MSHβ (هورمون محرّك ملاتونين) تولید میشود، ملاتونين كه از غدة پينه آل ترشّح مي شود باعث تغيير رنگ جانور مي شود. تاثیر این دو هورمون روی سلول های ملانوسیت پستانداران است. البته در حیوانات پست تر که دارای سلول های ملانوفور به جای ملانوسیت هستند، به علت گسترش بیشترهیپوفیز میانی، میزان تولید MSH بالاتر از پستانداران است. لذا در این موجودات تنوع رنگی بیشتری نسبت به پستانداران مشاهده می شود. . به طور مثال اين هورمون باعث مي شود راسوها در فصل زمستان رنگ سفيد و در تابستان رنگ تيره داشته باشند. رنگيزه ملانين در مو و نيز در سلولهاي ملانوسيت پوست از آمينو اسيد تيروزين ساخته مي شود. زماني كه اين رنگيزه در سلولهاي ملانوسيت تجمّع مي يابد رنگ پوست روشن و زماني كه پخش مي شود باعث تيره شدن پوست مي شود. ملاتونين باعث پخش اين رنگيزه ها در پوست و تيره شدن رنگ پوست مي شود.
ترکیبات دیگری نیز در این گروه جای دارند که به صورت واسطه های عصبی یا مواد تنظیم کننده عصبی مانند اندورفین ها عمل می کنند.
اندورفین ها ׃بتا اندورفین شامل 31اسی آمینه انتهای کربوکسیل β-LPHاست.آلفا و گاما اندورفین ترکیب تغییر یافته از بتا اندورفین هستند که به ترتیب با جدا شدن 15و14اسید آمینه از انتهای کربوکسیل مولکولی بتا-اندورفین به دست می آیند.این پپتید ها در غده هیپوفیز وجود دارند اما در این غده به صورت استیله بوده و احتمالا غیر فعال است . در جایگاه های دیگر این ترکیبات تغییر کرده و به این ترتیب احتمالا به صورت واسطه هلی عصبی یا تنظیم کننده های عصبی عمل می کنند .اندورفین ها در سیستم عصبی مرکزی به گیرنده های مشترکی با ترکیبات مخدر مرفینی اتصال می یابند و احتمالا در کنترل درونی درک درد نقشی به عهده دارند . قدرت ضد دردی این ترکیبات نسبت به مرفین بیشتر است . توالی مربوط به انکفالین نیز در ساختمان pomcوجود دارد اما قبل از آن اسیدها ی آمینه دی بازیک وجود نداشته و احتمالا این توالی تجزیه نشده یا بیان نمی شود.
β-LPH:این پپتید از 99 اسیدآمینه انتهای کربوکیسیل POMC تشکیل شده است.این هورمون موجب لیپولیز و تحرک اسیدهای چرب می شود.اثرات فیزیولوژیک آن بسیار ناچیز است ولی در کنترل خصوصیات رفتاری،تنظیم حرارت بدن و فشار خون و انقباض عضلات اندام های تناسلی نقش دارد.
α-MSH:از 13 اسیدآمینه N ترمینال ACTH ساخته شده و در ایجاد پیگمانتاسیون،رشد و فعالیت سلول های سروتولی بیضه و رفتارهای جنسی موثر است.MSH از طریق توزیع دانه های داخل سلولی ملانین، ملانوژنز را در بعضی گونه ها تحریک می کند و موجب تیره شدن پوست می شود.افراد مبتلا به آدیسون،بعلت افزایش فعالیت MSH پلاسما دچار هیپرپیگمانتاسیون هستند.
هورمون ACTH
نحوه تنظیم سنتز و ترشح هورمون ACTH
ACTH یک پلی پپتید تک زنجیره ای متشکل از 39 اسید آمینه است که رشد و فعالیت قشر آدرنال راتنظیم میکند . 24 اسیدآمینه انتهای آمینو برای فعالیت کامل بیولوژیک ضروری هستند ودر بین گونه ها بدون تغییر باقی می مانند، درحالی که 15 اسیدآمینه انتهای کربوکسیل کاملا متغیرند. ACTH با شکسته شدن یک گلیکوپروتئین با وزن ملکولی 31KD حاصل می شود.ترشح ACTH توسط فاکتور هیپوتالاموسی CRF تحریک شده و توسط استروئید های آدرنوکورتیکال مهار پس نورد می شود.سوماتواستاتین همچنین ترشح ACTH را مهار می کند
:: موضوعات مرتبط:
اخبار مهندسی زیست،
،
:: برچسبها:
هیپوفیز از نظر آناتومی و بافت شناسی,